Какие бывают химии
Содержание:
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;

Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:

Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:

В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).

Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
При этом следует учитывать изложенное выше правило о химической связи.

Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:

Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
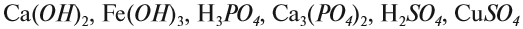
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях. Зная валентности атома или группы атомов можно составить формулу соединения
Для этого пользуются правилами:
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:

В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
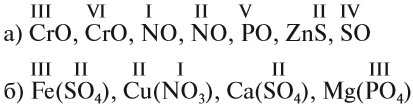

Что это такое
Перманентная, она же химическая завивка дает возможность носить пышные локоны до нескольких месяцев. Дело всё в химическом составе, которым обрабатываю волосы. Не углубляясь в химические подробности, скажем только, что форму волосу придают серные мостики или, если говорить по научному – дисульфидные связи. Как раз связи-мостики и рушат химические вещества, которыми обрабатываются волосы. Это дает возможность волосу принять абсолютно любое положение, которое можно определить типом бигудей и способом накрутки волос. Потом волосы обрабатываю специальным фиксатором, который укрепляет дисульфидные связи волос в новом положении. В итоге, когда бигуди снимают, волос удерживает новую для него форму – вьющуюся.
Днем рождения химической завивки волос является 16 ноября 1906 года. Как раз в этот день парикмахер К. Несслер на глазах у зрителей провел завивку волос собственной жены. Тогда для химической завивки использовались особые валики из латуни, которые разогревали до крайне высокой температуры, а потом обрабатывали волосы химическими веществами.
Добро пожаловать Вас приветствует АЛХИМИК
АЛХИМИК — ваш помощник, лоцман в море химических веществ и явлений. Он даст вам полезный совет, ответит на вопрос, удивит экспонатами химической Кунсткамеры, сообщит свежие химические новости — в том числе о свежеобъявленных конкурсах на получение грантов, премий и стипендий. Участвуйте и выигрывайте!!!
АЛХИМИК РЕКОМЕНДУЕТ: студентам-первокурсникам МИТХТ им. М.В. Ломоносова — полезные сведения и советы, домашние задания и программы, коллоквиумов и контрольных работ по неорганической химии, задачник, вопросник по неорганической химии и электронные пособия по неорганике — «Общие свойства растворов» , «Строение вещества», «Демонстрационные опыты по химии элементов», «Комплексные соединения» и «Протолитические равновесия». В рубрике ЦУ — Ценные указания — полезные статьи по сложным вопросам общей химии и химии элементов. Выложено пособие «Стехиометрические расчеты. Расчеты по уравнениям реакций» (МИТХТ, 2012 год)
Обратите внимание на презентации к лекциям 1 семестра:
Растворы электролитов. протонная теория кислот и оснований
Применение протонной теории к распространенным водным растворам
Протолитические равновесия. Гидролиз. Решение задач
Строение атомов и Периодический закон. Понятие о квантовой механике
Периодический закон и периодическая система химических элементов
Ковалентная химическая связь. Метод валентных связей. Полярность связей
Метод молекулярных орбиталей
Водородная связь. Межмолекулярное взаимодействие. Агрегатное состояние вещества
Для тех, кто изучает химию: презентации к лекциям по общей и неорганической химии — их перечень в рубрике ЦУ — Ценные указания. В презентациях много фотографий минералов и экспонатов из музея кафедры неорганической химии МИТХТ, схемы, таблицы, уравнения реакций и другая полезная информация.
А для студентов 1 курса магистратуры — лекции по методике преподавания химии
Лекция 1. Введение. Методы и средства обучения химии
Лекция 2. Искусство подготовки и чтения лекций и проведения семинаров
Лекция 3. Лабораторный практикум, методический аспект
Лекция 4. Оценка эффективности обучения химии
Лекция 5. Технология развития критического мышления
АЛХИМИК ПРИГЛАШАЕТ в Учительскую! Здесь — программы школьного курса химии, методические находки, вести из мира дистанционного образования и Начальный курс химии для педагогического эксперимента, а также рубрика «Химический кабинет» (модели и коллекции по химии: иллюстрированный каталог). НОВОЕ: от профессора Г.М. Курдюмова!
АЛХИМИК СОВЕТУЕТ: полезные сведения на каждый день — в доме и в саду, на кухне и во время стирки/уборки, при использовании домашней аптечки и средств косметики. АЛХИМИК помогает домашнему мастеру.
В запасе у АЛХИМИКА — химическая всячина: здесь отвечают на ваши вопросы, где в рубрике ЛЮДИ, АУ! — можно завести деловые знакомства и обменяться информацией, а также прочитать избранные места из переписки АЛХИМИКА.
Химия бывает не только полезной, но и веселой. А это значит, что химики шутят, подмечают казусы и ляпсусы, показывают химические ФОКУСЫ.
Будущие химики и нехимики! Добро пожаловать в Детскую! Это страничка для молодых родителей, их детей, для любящих бабушек и дедушек. Здесь вы увидите детские рисунки, сказки, придуманные детьми (и не только) и многое другое.
Нам помогает с дизайном и программированием сайт Роликовые коньки
Химический состав гидрокарбоната натрия

Как и любой продукт, используемый в питании, пищевая сода имеет пищевую ценность, которая определяется количеством белков, минералов, углеводов и макроэлементов. Состав соды пищевой определяется следующими показателями на 100 г съедобной части:
- зола — 36,9 г;
- вода — 0,2 г;
- натрий — 27,4 г;
- селен — 0,2 мкг.
В состав гидрокарбоната натрия не входят белки, жиры, углеводы и пищевые волокна, а ее калорийность составляет 0 ккал. Плотность соды — 2,16 г/см3.
Химическая формула соды NaHCO3 представляет собой кислую натриевую соль угольной кислоты, которая по международным атомным массам составляет 84,00 а.е.
При термических реакциях под воздействием температур от 60 градусов гидрокарбонат распадается на карбонат натрия, углекислый газ и воду. Температура кипения — 851°С, плавления — 270°С.
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
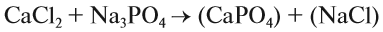
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:

3. Составим химические формулы полученных веществ по валентностям составных частей:
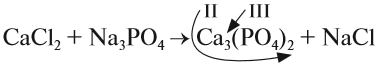
4
Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
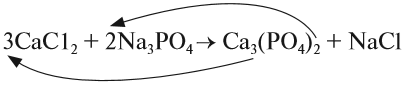
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:

Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:

3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:

Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
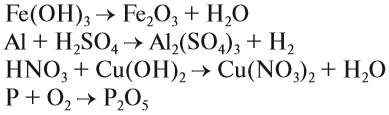

Названия химических элементов
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113* | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115* | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117* | Ts | Tennessine | Тенессин |
| 118* | Og | Oganesson | Оганессон |
Символы и названия элементов даны по материалам 2009
г. IUPAC (International Union of Pure and Applied
Chemistry) (см.
Pure Appl. Chem.,2011,83,
359-396).
ATOMIC WEIGHTS OF THE
ELEMENTS 2009
Имена flerovium (Fl) для 114-го элемента и livermorium (Lv) для 116-го элемента
были одобрены (см.
Pure Appl. Chem.,2012,84,
1669-1672)
* После утверждения открытия этих элементов, первооткрывателям было
предложено дать им имена. Отдел неорганической химии IUPAC рассмотрел эти
предложения и рекомендует их для принятия. До официального утверждения имен
советом IUPAC, проходит пятимесячного публичное обсуждение, которое закончится 8
ноября 2016 года.(см.
http://iupac.org/elements.html)